Аминокиселините в полипептидната верига са свързани с амидна връзка, която се образува между α-карбоксилната група на едната и α-аминогрупата на следващата аминокиселина (фиг. 1). Ковалентната връзка, образувана между аминокиселините, се нарича пептидна връзка.Кислородните и водородните атоми на пептидната група в този случай заемат транспозиция.
Ориз. 1. Схема на образуване на пептидна връзка.Във всеки протеин или пептид може да се разграничи: N-крайпротеин или пептид, който има свободна а-амино група (-NH2);
S-крайсъс свободна карбоксилна група (-СООН);
Пептиден гръбнакпротеини, състоящи се от повтарящи се фрагменти: -NH-CH-CO-; Аминокиселинни радикали(странични вериги) (R1И R2)- променливи групи.
Съкратеното обозначение на полипептидната верига, както и протеиновият синтез в клетките, задължително започва от N-края и завършва в С-края:
Имената на аминокиселините, включени в пептида и образуващи пептидна връзка, имат окончания -аз ще.Например трипептидът по-горе се нарича треонил-хистидил-пролин.
Единствената променлива част, която отличава един протеин от всички останали, е комбинацията от радикали (странични вериги) на аминокиселините, които го изграждат. По този начин индивидуалните свойства и функции на протеина се определят от структурата и последователността на аминокиселините в полипептидната верига.
Полипептидните вериги на различни телесни протеини могат да включват от няколко аминокиселини до стотици и хиляди аминокиселинни остатъци. Тяхното молекулно тегло (молекулно тегло) също варира в широки граници. И така, хормонът вазопресин се състои от 9 аминокиселини, казват те. маса 1070 kD; инсулин - от 51 аминокиселини (в 2 вериги), казват. маса 5733 kD; лизозим - от 129 аминокиселини (1 верига), казват. маса 13 930 kD; хемоглобин - от 574 аминокиселини (4 вериги), казват. маса 64 500 kD; колаген (тропоколаген) - от около 1000 аминокиселини (3 вериги), казват. маса ~130 000 kD.
Свойствата и функцията на протеина зависят от структурата и реда на редуване на аминокиселините във веригата, промяната в аминокиселинния състав може значително да ги промени. И така, 2 хормона на задната хипофизна жлеза - окситоцин и вазопресин - са нанопептиди и се различават в 2 от 9 аминокиселини (в позиции 3 и 8):
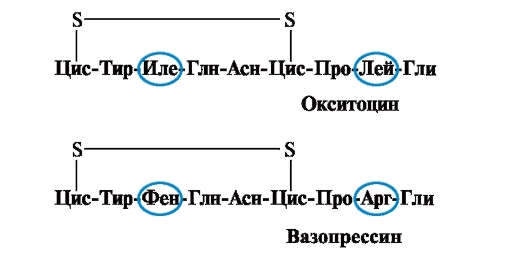
Основният биологичен ефект на окситоцина е да стимулира свиването на гладката мускулатура на матката по време на раждане, а вазопресинът предизвиква реабсорбция на вода в бъбречните тубули (антидиуретичен хормон) и има вазоконстрикторно свойство. Така, въпреки голямото структурно сходство, физиологичната активност на тези пептиди и таргетната тъкан, върху която действат, се различават, т.е. замяната само на 2 от 9 аминокиселини причинява значителна промяна във функцията на пептида.
Понякога много малка промяна в структурата на голям протеин причинява потискане на неговата активност. И така, ензимът алкохол дехидрогеназа, който разгражда етанола в черния дроб на човека, се състои от 500 аминокиселини (в 4 вериги). Активността му сред жителите на азиатския регион (Япония, Китай и др.) е много по-ниска, отколкото сред жителите на Европа. Това се дължи на факта, че в полипептидната верига на ензима глутаминовата киселина е заменена с лизин на позиция 487.
Взаимодействията между аминокиселинните радикали са от голямо значение за стабилизирането на пространствената структура на протеините; могат да се разграничат 4 вида химични връзки: хидрофобни, водородни, йонни, дисулфидни.
Хидрофобни връзкивъзникват между неполярни хидрофобни радикали (фиг. 2). Те играят водеща роля при формирането на третичната структура на белтъчната молекула.
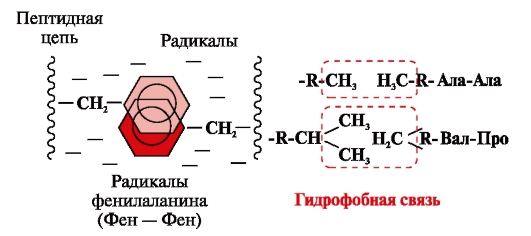
Ориз. 2. Хидрофобни взаимодействия между радикалите
Водородни връзки- образуват се между полярни (хидрофилни) незаредени групи от радикали, имащи подвижен водороден атом, и групи с електроотрицателен атом (-O или -N-) (фиг. 3).
Йонни връзкисе образуват между полярни (хидрофилни) йонни радикали с противоположно заредени групи (фиг. 4).
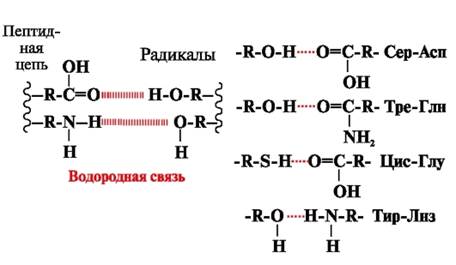
Ориз. 3. Водородни връзки между аминокиселинните радикали
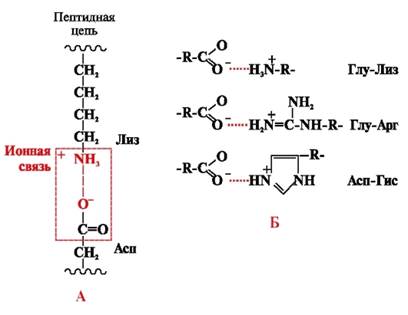
Ориз. 4. Йонна връзка между радикалите на лизин и аспарагинова киселина (A) и примери за йонни взаимодействия (B)
дисулфидна връзка- ковалентен, образуван от две сулфхидрилни (тиолови) групи от цистеинови радикали, разположени на различни места на полипептидната верига (фиг. 5). Намира се в протеини като инсулин, инсулинов рецептор, имуноглобулини и др.
Дисулфидните връзки стабилизират пространствената структура на една полипептидна верига или свързват 2 вериги заедно (например вериги А и В на инсулиновия хормон) (фиг. 6).
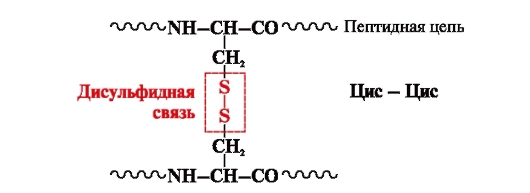
Ориз. 5. Образуване на дисулфидна връзка.

Ориз. 6. Дисулфидни връзки в молекулата на инсулина.Дисулфидни връзки: между цистеинови остатъци от една и съща верига А(а), между веригите АИ IN(б). Числа - позиция на аминокиселините в полипептидните вериги.



