Aminokisline v polipeptidni verigi so povezane z amidno vezjo, ki nastane med α-karboksilno skupino ene in α-amino skupino naslednje aminokisline (slika 1). Kovalentna vez, ki nastane med aminokislinami, se imenuje peptidna vez. Atomi kisika in vodika peptidne skupine v tem primeru zasedajo transpozicijo.
riž. 1. Shema tvorbe peptidne vezi.V vsakem proteinu ali peptidu lahko ločimo: N-konec protein ali peptid, ki ima prosto a-amino skupino (-NH2);
S-konecs prosto karboksilno skupino (-COOH);
Peptidna hrbtenicabeljakovine, sestavljene iz ponavljajočih se fragmentov: -NH-CH-CO-; Aminokislinski radikali(stranske verige) (R1 in R2)- variabilne skupine.
Skrajšani zapis polipeptidne verige, kot tudi sinteza beljakovin v celicah, se nujno začne na N-koncu in konča na C-koncu:
Imena aminokislin, ki so vključene v peptid in tvorijo peptidno vez, imajo končnice -bolezen. Na primer, zgornji tripeptid se imenuje treonil-histidil-prolin.
Edini variabilni del, ki loči en protein od vseh drugih, je kombinacija radikalov (stranskih verig) aminokislin, ki ga sestavljajo. Tako so posamezne lastnosti in funkcije proteina določene s strukturo in zaporedjem aminokislin v polipeptidni verigi.
Polipeptidne verige različnih telesnih beljakovin lahko vključujejo od nekaj aminokislin do več sto in tisoče aminokislinskih ostankov. Tudi njihova molekulska masa (molekulska masa) je zelo različna. Torej, hormon vazopresin je sestavljen iz 9 aminokislin, pravijo. masa 1070 kD; inzulin - iz 51 aminokislin (v 2 verigah), pravijo. masa 5733 kD; lizocim - iz 129 aminokislin (1 veriga), pravijo. masa 13 930 kD; hemoglobin – iz 574 aminokislin (4 verige), pravijo. masa 64.500 kD; kolagen (tropokolagen) – iz približno 1000 aminokislin (3 verige), pravijo. masa ~130.000 kD.
Lastnosti in delovanje beljakovine so odvisne od zgradbe in vrstnega reda menjavanja aminokislin v verigi, sprememba aminokislinske sestave jih lahko močno spremeni. Torej, 2 hormona zadnje hipofize - oksitocin in vazopresin - sta nanopeptida in se razlikujeta v 2 od 9 aminokislin (na mestih 3 in 8):
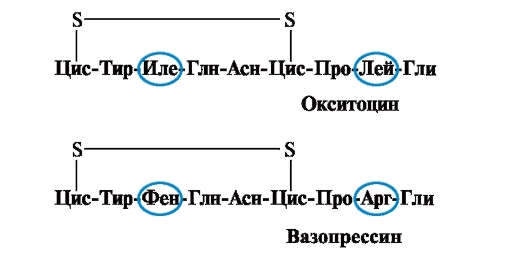
Glavni biološki učinek oksitocina je spodbujanje krčenja gladkih mišic maternice med porodom, vazopresin pa povzroči reabsorpcijo vode v ledvičnih tubulih (antidiuretični hormon) in ima vazokonstrikcijsko lastnost. Tako se kljub veliki strukturni podobnosti fiziološka aktivnost teh peptidov in ciljno tkivo, na katerega delujejo, razlikujeta, t.j. zamenjava samo 2 od 9 aminokislin povzroči pomembno spremembo v delovanju peptida.
Včasih zelo majhna sprememba v strukturi velikega proteina povzroči zatiranje njegove aktivnosti. Tako je encim alkohol dehidrogenaza, ki razgrajuje etanol v človeških jetrih, sestavljen iz 500 aminokislin (v 4 verigah). Njegova aktivnost med prebivalci azijske regije (Japonska, Kitajska itd.) je precej manjša kot med prebivalci Evrope. To je posledica dejstva, da je v polipeptidni verigi encima glutaminska kislina na mestu 487 nadomeščena z lizinom.
Interakcije med radikali aminokislin so velikega pomena pri stabilizaciji prostorske strukture proteinov; ločimo 4 vrste kemijskih vezi: hidrofobne, vodikove, ionske, disulfidne.
Hidrofobne vezi nastanejo med nepolarnimi hidrofobnimi radikali (slika 2). Imajo vodilno vlogo pri tvorbi terciarne strukture proteinske molekule.
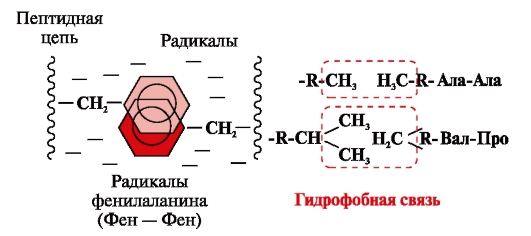
riž. 2. Hidrofobne interakcije med radikali
Vodikove vezi- nastanejo med polarnimi (hidrofilnimi) nenabitimi skupinami radikalov, ki imajo gibljiv atom vodika, in skupinami z elektronegativnim atomom (-O ali -N-) (slika 3).
Ionske vezi nastanejo med polarnimi (hidrofilnimi) ionskimi radikali z nasprotno nabitimi skupinami (slika 4).
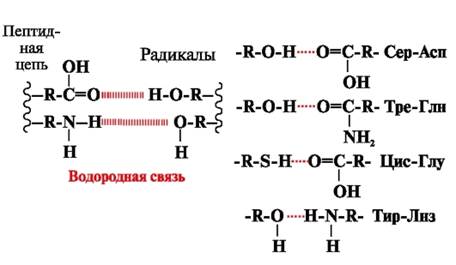
riž. 3. Vodikove vezi med radikali aminokislin
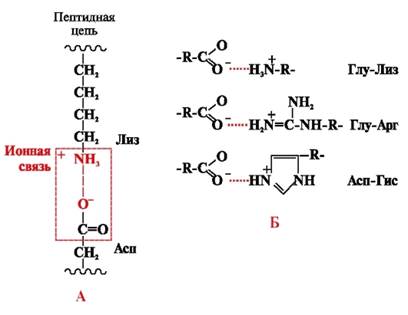
riž. 4. Ionska vez med radikaloma lizina in asparaginske kisline (A) in primeri ionskih interakcij (B)
disulfidna vez- kovalentna, ki jo tvorita dve sulfhidrilni (tiolni) skupini cisteinskih radikalov, ki se nahajata na različnih mestih polipeptidne verige (slika 5). Najdemo ga v beljakovinah, kot so inzulin, insulinski receptor, imunoglobulini itd.
Disulfidne vezi stabilizirajo prostorsko strukturo ene polipeptidne verige ali povezujejo 2 verigi skupaj (na primer verigi A in B insulinskega hormona) (slika 6).
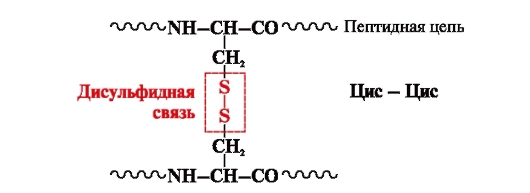
riž. 5. Tvorba disulfidne vezi.

riž. 6. Disulfidne vezi v molekuli insulina. Disulfidne vezi: med cisteinskimi ostanki iste verige A(a), med verigami A in IN(b). Številke - položaj aminokislin v polipeptidnih verigah.



