Aminokyseliny v polypeptidovém řetězci jsou spojeny amidovou vazbou, která vzniká mezi α-karboxylovou skupinou jedné a α-aminoskupinou další aminokyseliny (obr. 1). Kovalentní vazba vytvořená mezi aminokyselinami se nazývá peptidová vazba. Atomy kyslíku a vodíku peptidové skupiny v tomto případě zaujímají transpozici.
Rýže. 1. Schéma tvorby peptidové vazby.V každém proteinu nebo peptidu lze rozlišit: N-konec protein nebo peptid, který má volnou a-aminoskupinu (-NH2);
Poslatmající volnou karboxylovou skupinu (-COOH);
Peptidová páteřproteiny sestávající z opakujících se fragmentů: -NH-CH-CO-; Aminokyselinové radikály(boční řetězy) (R1 A R2)- variabilní skupiny.
Zkrácený zápis polypeptidového řetězce, stejně jako syntéza proteinů v buňkách, nutně začíná na N-konci a končí na C-konci:
Názvy aminokyselin obsažených v peptidu a tvořících peptidovou vazbu mají koncovky -nemocný. Například výše uvedený tripeptid se nazývá threonyl-histidyl-prolin.
Jedinou variabilní částí, která odlišuje jeden protein od všech ostatních, je kombinace radikálů (postranních řetězců) aminokyselin, které ho tvoří. Jednotlivé vlastnosti a funkce proteinu jsou tedy určeny strukturou a sekvencí aminokyselin v polypeptidovém řetězci.
Polypeptidové řetězce různých tělesných proteinů mohou zahrnovat několik aminokyselin až stovky a tisíce aminokyselinových zbytků. Jejich molekulová hmotnost (molekulová hmotnost) se také velmi liší. Takže hormon vasopresin se skládá z 9 aminokyselin, říkají. hmotnost 1070 kD; inzulín - z 51 aminokyselin (ve 2 řetězcích), říkají. hmotnost 5733 kD; lysozym - ze 129 aminokyselin (1 řetězec), říkají. hmotnost 13 930 kD; hemoglobin - z 574 aminokyselin (4 řetězce), říkají. hmotnost 64 500 kD; kolagen (tropokolagen) - z asi 1000 aminokyselin (3 řetězce), říkají. hmotnost ~130 000 kD.
Vlastnosti a funkce proteinu závisí na struktuře a pořadí střídání aminokyselin v řetězci, změna složení aminokyselin je může velmi změnit. Takže 2 hormony zadní hypofýzy - oxytocin a vasopresin - jsou nanopeptidy a liší se ve 2 z 9 aminokyselin (v pozicích 3 a 8):
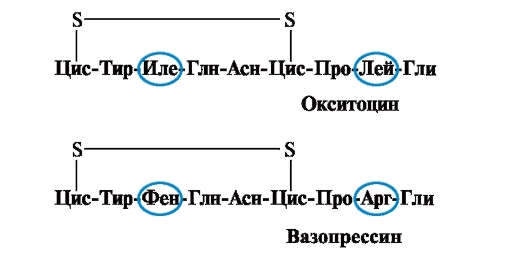
Hlavním biologickým účinkem oxytocinu je stimulace kontrakce hladkého svalstva dělohy během porodu a vasopresin způsobuje reabsorpci vody v renálních tubulech (antidiuretický hormon) a má vazokonstrikční vlastnost. I přes velkou strukturní podobnost se tedy fyziologická aktivita těchto peptidů a cílová tkáň, na kterou působí, liší, tzn. nahrazení pouze 2 z 9 aminokyselin způsobuje významnou změnu funkce peptidu.
Někdy velmi malá změna ve struktuře velkého proteinu způsobí potlačení jeho aktivity. Enzym alkoholdehydrogenáza, který štěpí ethanol v lidských játrech, se tedy skládá z 500 aminokyselin (ve 4 řetězcích). Jeho aktivita mezi obyvateli asijské oblasti (Japonsko, Čína atd.) je mnohem nižší než mezi obyvateli Evropy. To je způsobeno skutečností, že v polypeptidovém řetězci enzymu je kyselina glutamová v pozici 487 nahrazena lysinem.
Velký význam při stabilizaci prostorové struktury proteinů mají interakce mezi aminokyselinovými radikály, lze rozlišit 4 typy chemických vazeb: hydrofobní, vodíkové, iontové, disulfidové.
Hydrofobní vazby vznikají mezi nepolárními hydrofobními radikály (obr. 2). Hrají vedoucí roli při tvorbě terciární struktury molekuly proteinu.
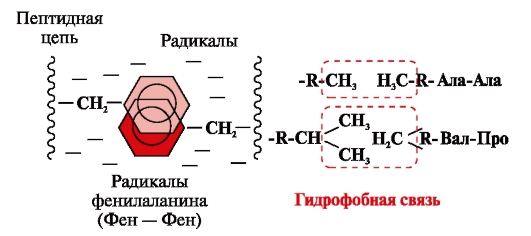
Rýže. 2. Hydrofobní interakce mezi radikály
Vodíkové vazby- vznikají mezi polárními (hydrofilními) nenabitými skupinami radikálů s pohyblivým atomem vodíku a skupinami s elektronegativním atomem (-O nebo -N-) (obr. 3).
Iontové vazby vznikají mezi polárními (hydrofilními) iontovými radikály s opačně nabitými skupinami (obr. 4).
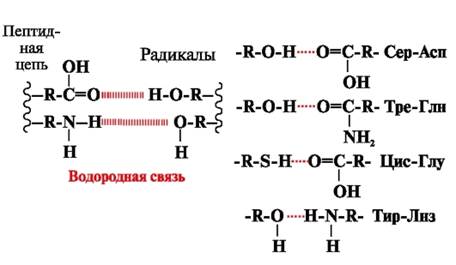
Rýže. 3. Vodíkové vazby mezi radikály aminokyselin
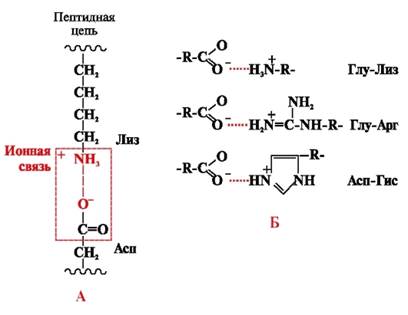
Rýže. 4. Iontová vazba mezi radikály lysinu a kyseliny asparagové (A) a příklady iontových interakcí (B)
disulfidická vazba- kovalentní, tvořená dvěma sulfhydrylovými (thiolovými) skupinami cysteinových radikálů umístěných na různých místech polypeptidového řetězce (obr. 5). Nachází se v proteinech, jako je inzulín, inzulínový receptor, imunoglobuliny atd.
Disulfidové vazby stabilizují prostorovou strukturu jednoho polypeptidového řetězce nebo spojují 2 řetězce dohromady (například řetězce A a B inzulínového hormonu) (obr. 6).
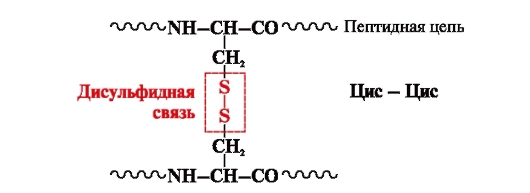
Rýže. 5. Vznik disulfidové vazby.

Rýže. 6. Disulfidové vazby v molekule inzulínu. Disulfidové vazby: mezi cysteinovými zbytky stejného řetězce A a), mezi řetězy A A V(b). Čísla - pozice aminokyselin v polypeptidových řetězcích.



