Aminokiseline u polipeptidnom lancu su povezane amidnom vezom, koja se formira između α-karboksilne grupe jedne i α-amino grupe sledeće amino kiseline (slika 1). Kovalentna veza nastala između aminokiselina naziva se peptidnu vezu. Atomi kiseonika i vodonika peptidne grupe u ovom slučaju zauzimaju transpoziciju.
Rice. 1. Šema formiranja peptidne veze.U svakom proteinu ili peptidu može se razlikovati: N-terminus protein ili peptid koji ima slobodnu a-amino grupu (-NH2);
S-krajima slobodnu karboksilnu grupu (-COOH);
Peptidna kičmaproteini koji se sastoje od fragmenata koji se ponavljaju: -NH-CH-CO-; Radikali aminokiselina(bočni lanci) (R1 I R2)- varijabilne grupe.
Skraćeni zapis polipeptidnog lanca, kao i sinteza proteina u ćelijama, nužno počinje na N-kraju i završava se na C-kraju:
Imena aminokiselina uključenih u peptid i koje formiraju peptidnu vezu imaju završetke -ill. Na primjer, tripeptid iznad se zove treonil-histidil-prolin.
Jedini varijabilni dio koji razlikuje jedan protein od svih ostalih je kombinacija radikala (bočnih lanaca) aminokiselina koje ga čine. Dakle, pojedinačna svojstva i funkcije proteina su određene strukturom i sekvencom aminokiselina u polipeptidnom lancu.
Polipeptidni lanci različitih tjelesnih proteina mogu uključivati od nekoliko aminokiselina do stotina i hiljada aminokiselinskih ostataka. Njihova molekularna težina (molekularna težina) također uvelike varira. Dakle, hormon vazopresin se sastoji od 9 aminokiselina, kažu. masa 1070 kD; insulin - od 51 aminokiseline (u 2 lanca), kažu. masa 5733 kD; lizozim - od 129 aminokiselina (1 lanac), kažu. masa 13 930 kD; hemoglobin - od 574 aminokiseline (4 lanca), kažu. masa 64.500 kD; kolagen (tropokolagen) - od oko 1000 aminokiselina (3 lanca), kažu. masa ~130,000 kD.
Svojstva i funkcija proteina ovise o strukturi i redoslijedu izmjenjivanja aminokiselina u lancu, a promjena u sastavu aminokiselina može ih uvelike promijeniti. Dakle, 2 hormona zadnje hipofize - oksitocin i vazopresin - su nanopeptidi i razlikuju se u 2 od 9 aminokiselina (na pozicijama 3 i 8):
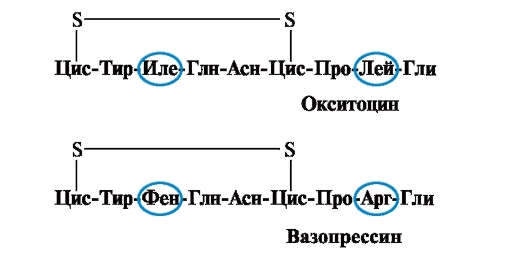
Glavni biološki efekat oksitocina je da stimuliše kontrakciju glatkih mišića materice tokom porođaja, a vazopresin izaziva reapsorpciju vode u bubrežnim tubulima (antidiuretički hormon) i ima vazokonstriktivno svojstvo. Dakle, uprkos velikoj strukturnoj sličnosti, fiziološka aktivnost ovih peptida i ciljnog tkiva na koje deluju se razlikuju, tj. zamjena samo 2 od 9 aminokiselina uzrokuje značajnu promjenu u funkciji peptida.
Ponekad vrlo mala promjena u strukturi velikog proteina uzrokuje potiskivanje njegove aktivnosti. Dakle, enzim alkohol dehidrogenaza, koji razgrađuje etanol u ljudskoj jetri, sastoji se od 500 aminokiselina (u 4 lanca). Njegova aktivnost među stanovnicima azijske regije (Japan, Kina, itd.) je mnogo niža nego među stanovnicima Evrope. To je zbog činjenice da je u polipeptidnom lancu enzima glutaminska kiselina zamijenjena lizinom na poziciji 487.
Interakcije između radikala aminokiselina su od velike važnosti za stabilizaciju prostorne strukture proteina; mogu se razlikovati 4 vrste hemijskih veza: hidrofobna, vodikova, jonska, disulfidna.
Hidrofobne veze nastaju između nepolarnih hidrofobnih radikala (slika 2). Oni igraju vodeću ulogu u formiranju tercijarne strukture proteinske molekule.
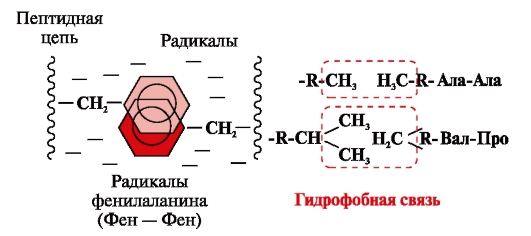
Rice. 2. Hidrofobne interakcije između radikala
Vodikove veze- nastaju između polarnih (hidrofilnih) nenabijenih grupa radikala koji imaju mobilni atom vodika i grupa sa elektronegativnim atomom (-O ili -N-) (slika 3).
Jonske veze nastaju između polarnih (hidrofilnih) ionskih radikala koji imaju suprotno nabijene grupe (slika 4).
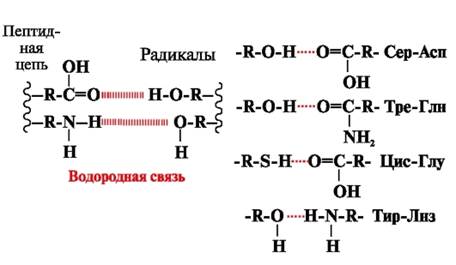
Rice. 3. Vodikove veze između radikala aminokiselina
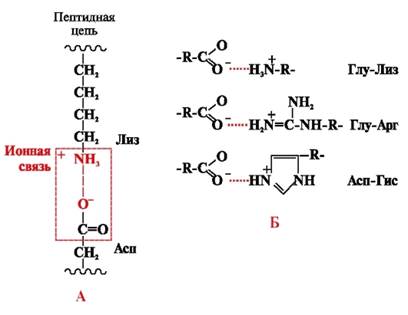
Rice. 4. Jonska veza između lizina i radikala asparaginske kiseline (A) i primjeri ionskih interakcija (B)
disulfidna veza- kovalentna, formirana od dvije sulfhidrilne (tiolne) grupe cisteinskih radikala smještenih na različitim mjestima polipeptidnog lanca (slika 5). Nalazi se u proteinima kao što su insulin, insulinski receptor, imunoglobulini itd.
Disulfidne veze stabilizuju prostornu strukturu jednog polipeptidnog lanca ili povezuju 2 lanca zajedno (na primer, lanci A i B hormona insulina) (slika 6).
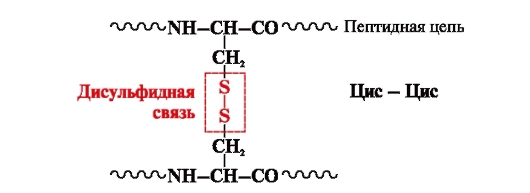
Rice. 5. Formiranje disulfidne veze.

Rice. 6. Disulfidne veze u molekulu insulina. Disulfidne veze: između cisteinskih ostataka istog lanca A(a), između lanaca A I IN(b). Brojevi - položaj aminokiselina u polipeptidnim lancima.



