Les acides aminés de la chaîne polypeptidique sont liés par une liaison amide, qui est formée entre le groupe α-carboxyle de l'un et le groupe α-amino de l'acide aminé suivant (Fig. 1). La liaison covalente formée entre les acides aminés est appelée liaison peptidique. Les atomes d'oxygène et d'hydrogène du groupe peptidique occupent dans ce cas une transposition.
Riz. 1. Schéma de formation de liaison peptidique.Dans chaque protéine ou peptide, on peut distinguer : N-terminal une protéine ou un peptide qui a un groupe a-amino libre (-NH2);
Envoyerayant un groupe carboxyle libre (-COOH);
Squelette peptidiqueprotéines, constituées de fragments répétitifs : -NH-CH-CO-; Radicaux d'acides aminés(chaînes latérales) (R1 Et R2)- groupes variables.
La notation abrégée de la chaîne polypeptidique, ainsi que la synthèse des protéines dans les cellules, commence nécessairement à l'extrémité N-terminale et se termine à l'extrémité C-terminale :
Les noms des acides aminés inclus dans le peptide et formant une liaison peptidique ont les terminaisons -je vais. Par exemple, le tripeptide ci-dessus est appelé thréonyl-histidyl-proline.
La seule partie variable qui distingue une protéine de toutes les autres est la combinaison des radicaux (chaînes latérales) des acides aminés qui la composent. Ainsi, les propriétés et fonctions individuelles d'une protéine sont déterminées par la structure et la séquence des acides aminés dans la chaîne polypeptidique.
Les chaînes polypeptidiques de diverses protéines corporelles peuvent comprendre de quelques acides aminés à des centaines et des milliers de résidus d'acides aminés. Leur poids moléculaire (poids moléculaire) varie également considérablement. Ainsi, l'hormone vasopressine se compose de 9 acides aminés, disent-ils. masse 1070 kD; insuline - à partir de 51 acides aminés (en 2 chaînes), disent-ils. masse 5733 kD; lysozyme - à partir de 129 acides aminés (1 chaîne), disent-ils. masse 13 930 kD ; hémoglobine - à partir de 574 acides aminés (4 chaînes), disent-ils. masse 64 500 kD; collagène (tropocollagène) - d'environ 1000 acides aminés (3 chaînes), disent-ils. masse ~130 000 kD.
Les propriétés et la fonction d'une protéine dépendent de la structure et de l'ordre d'alternance des acides aminés dans la chaîne, une modification de la composition en acides aminés peut grandement les modifier. Ainsi, 2 hormones de l'hypophyse postérieure - l'ocytocine et la vasopressine - sont des nanopeptides et diffèrent par 2 des 9 acides aminés (en positions 3 et 8) :
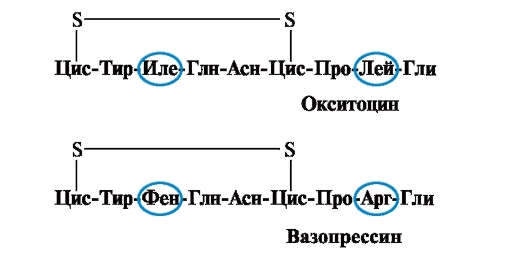
Le principal effet biologique de l'ocytocine est de stimuler la contraction des muscles lisses de l'utérus lors de l'accouchement, et la vasopressine provoque la réabsorption d'eau dans les tubules rénaux (hormone antidiurétique) et possède une propriété vasoconstrictrice. Ainsi, malgré la grande similitude structurelle, l'activité physiologique de ces peptides et le tissu cible sur lequel ils agissent diffèrent, c'est-à-dire le remplacement de seulement 2 des 9 acides aminés provoque un changement significatif dans la fonction du peptide.
Parfois, un très petit changement dans la structure d'une grande protéine provoque la suppression de son activité. Ainsi, l'enzyme alcool déshydrogénase, qui décompose l'éthanol dans le foie humain, se compose de 500 acides aminés (en 4 chaînes). Son activité chez les habitants de la région asiatique (Japon, Chine, etc.) est beaucoup plus faible que chez les habitants de l'Europe. Cela est dû au fait que dans la chaîne polypeptidique de l'enzyme, l'acide glutamique est remplacé par la lysine en position 487.
Les interactions entre les radicaux d'acides aminés sont d'une grande importance dans la stabilisation de la structure spatiale des protéines ; on distingue 4 types de liaisons chimiques : hydrophobe, hydrogène, ionique, disulfure.
Liaisons hydrophobes apparaissent entre des radicaux hydrophobes non polaires (Fig. 2). Ils jouent un rôle de premier plan dans la formation de la structure tertiaire de la molécule protéique.
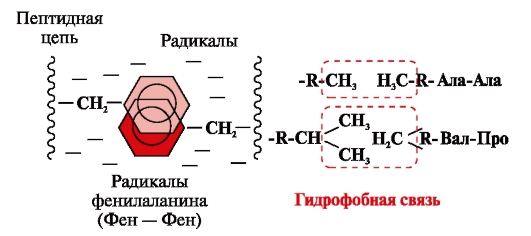
Riz. 2. Interactions hydrophobes entre radicaux
Liaisons hydrogène- se forment entre des groupements polaires (hydrophiles) non chargés de radicaux à atome d'hydrogène mobile, et des groupements à atome électronégatif (-O ou -N-) (Fig. 3).
Des liaisons ioniques se forment entre des radicaux ioniques polaires (hydrophiles) ayant des groupes de charges opposées (Fig. 4).
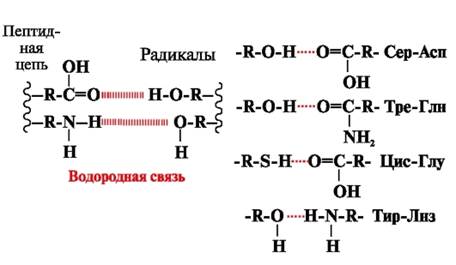
Riz. 3. Liaisons hydrogène entre les radicaux d'acides aminés
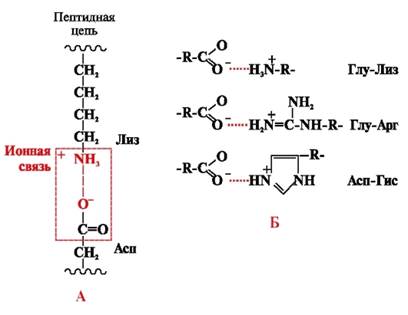
Riz. 4. Liaison ionique entre les radicaux lysine et acide aspartique (A) et exemples d'interactions ioniques (B)
Un pont disulfure- covalent, formé de deux groupes sulfhydryle (thiol) de radicaux cystéine situés à des endroits différents de la chaîne polypeptidique (Fig. 5). On le trouve dans des protéines telles que l'insuline, le récepteur de l'insuline, les immunoglobulines, etc.
Les liaisons disulfure stabilisent la structure spatiale d'une chaîne polypeptidique ou relient 2 chaînes ensemble (par exemple, les chaînes A et B de l'hormone insuline) (Fig. 6).
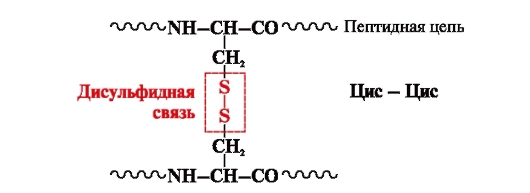
Riz. 5. Formation d'une liaison disulfure.

Riz. 6. Liaisons disulfure dans la molécule d'insuline. Liaisons disulfure : entre résidus cystéine d'une même chaîne UN(a), entre les chaînes UN Et DANS(b). Nombres - position des acides aminés dans les chaînes polypeptidiques.



